Postęp genomiki zwierząt domowych, możliwość prowadzenia szerokich porównawczych analiz genomowych oraz powszechna dostępność nowoczesnych
narzędzi i technik molekularnych (np. mikromacierze SNP, sekwencjonowanie DNA nowej generacji) zaowocowały identyfikacją wielu mutacji odpowiedzialnych za monogenowe choroby psów (24). Z kolei wiedza o podłożu molekularnym często występujących u psów chorób lub wad o złożonym uwarunkowaniu (np. otyłość, cukrzyca typu 2, dysplazja stawu biodrowego lub łokciowego, wnętrostwo), czyli takich, które zależą od wielu genów oraz czynników środowiskowych, a także interakcji między nimi, nie jest tak zaawansowana. Wiedza o markerach genetycznych związanych z predyspozycją do rozwoju takich chorób lub wad jest zatem aktualnym wyzwaniem, ważnym dla wczesnej diagnostyki ryzyka ich powstania, nawet przed pojawieniem się pierwszych objawów.
Dysplazja stawu biodrowego (CHD, canine hip dysplasia) to wada rozwojowa układu szkieletowego, która zalicza się do najczęściej występującego zaburzenia u psów. Na rozwój tej wady wpływają zarówno czynniki środowiskowe, jak igeny. Do głównych czynników pozagenetycznych sprzyjających rozwojowi CHD zalicza się m.in.: wysoką masę urodzeniową, nadmierne karmienie prowadzące do szybkiego wzrostu masy ciała, nadmierną suplementację wapniem czy wczesną sterylizację, a także zbyt intensywne obciążenie ruchowe psa w okresie wzrostu (16). Najbardziej dynamiczny rozwój tej wady ma miejsce w przedziale wiekowym od 4 do 10 miesięcy. U rosnących szczniąt pojawiają się początkowo zaburzenia w obrębie elementów łącznotkankowych stawu biodrowego oraz mięśni pasa miednicowego. Prowadzą one do niewłaściwego rozkładu sił przenoszonych w stawie biodrowym i są przyczyną inkogruencji powierzchni stawowych. Sugeruje się również, że CHD jest procesem dynamicznym, w trakcie którego możliwe jest rozróżnienie dysplazji miednicy(dotyczącej nieprawidłowości panewek) od dysplazji kości udowej, charakteryzującej się anormalnością w długości, inklinacji i antewersji szyjki kości udowej (1, 26).Badania diagnostyczne oparte są przede wszystkim na radiologicznej ocenie rozwoju stawu biodrowego (10, 16), a rzadziej na ocenie ultrasonograficznej (8, 15). Ostateczną ocenę wystawia się po ukończeniu przez psa 12. miesiąca życia. Podstawowym badaniem radiologicznym jest tzw. projekcja brzuszno-grzbietowa (VD) z ekstenzją stawów biodrowych i kolanowych (wg. Standardów Orthopedic Foundation for Animals OFA). Uzyskanie wiarygodnej dokumentacji radiologicznej wymaga farmakologicznego uspokojenia pacjenta w celu ułożenia go symetrycznie na grzbiecie, z równoległym położeniem kości udowych, przy czym rzepki powinny znajdować się pośrodku bloczka kości udowej. Kadr zdjęcia rtg powinien obejmować stawy krzyżowo-biodrowe oraz kolana. Prawidłowość rozwoju stawu biodrowego ocenia się w skali od A do E, zgodnie z systemem rekomendowanym przez FCI (Fédération Cynologique Internationale), gdzie ocena A oznacza stawy biodrowe wolne od dysplazji, a ocena E dysplazję ciężką. Diagnostyka radiologiczna CHD jest obowiązkowa w odniesieniu do psów hodowlanych 24 ras (załącznik nr 10 do Regulaminu Hodowli Psów Rasowych Związku Kynologicznego w Polsce), w tym: wszystkich retrieverów, owczarka niemieckiego, owczarka podhalańskiego, polskiego owczarka nizinnego, bernardyna, boksera, berneńskiego psa pasterskiego itd. Badanie takie jest wykonywane, zgodnie z zaleceniami FCI, powyżej 12. miesiąca życia, aw przypadku ras dużych powyżej 18. miesiąca życia.Dość powszechnie przyjmuje się, że dysplazja stawu biodrowego występuje przede wszystkim w rasach charakteryzujących się dużą masą ciała. Warto jednak zauważyć, że nie jest to uniwersalna relacja, bowiem znane są rasy małe, w których CHD diagnozowane jest często oraz duże, w których ta wada występuje bardzo rzadko.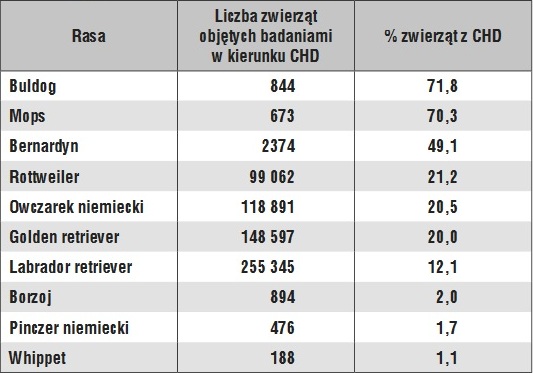 (tabelka1)
(tabelka1)
Zgodnie z danymi prezentowanymi przez Orthopedic Foundation for Animals (http://www.ofa.org/stats_hip.html), CHD występuje z częstością od poniżej 2% (pinczer niemiecki, whippet) do ponad 70% (buldog, mops). Powyższe obserwacje uzasadniają przypuszczenie, że w pulach genowych niektórych ras występują warianty predysponujące do rozwoju tej wady.
W polskich warunkach rasami, które najczęściej były diagnozowane w kierunku CHD, są owczarki niemieckie, rottweilery i berneńskie psy pasterskie (2), a w ostatnich latach również labradory (Gogulski, niepublikowane). Dwie z wymienionych ras (labrador retriever i owczarek niemiecki) są głównymi obiektami badań, których celem jest identyfikacja markerówgenetycznych predysponujących do rozwoju tej wady.
Dziedziczne podłoże dysplazji stawu biodrowego.
Udział czynników genetycznych w kształtowaniu zmienności cech ilościowych (np. masa ciała, wzrost itp.) oraz chorób i wad o złożonym podłożu, takich jak CHD, wyrażany jest przy pomocy współczynnika odziedziczalności (h2). Jego wartość zawiera się w przedziale od 0 do 1, przy czym wartości przekraczające 0,5 świadczą o dużym znaczeniu czynników genetycznych. Podkreślić należy, że dla tej samej cechy, choroby czy wady złożonej wartość h2 może kształtować się na różnym poziomie w różnych rasach czy populacjach. Wynika to z tego, że rasy różnią się zmiennością genetyczną (pulami genowymi), a badane populacje mogą bytować w zróżnicowanych warunkach środowiskowych. Wodniesieniu do CHD wartość h2, szacowana dla różnych ras, populacji i przez różnych autorów, jest zróżnicowana i mieści się w zakresie od 0,46 (seter angielski) do 0,75 (bokser), z tym jednak, że dla większości ras wartość ta zawiera się w przedziale od 0,5 do 0,6 (21). Oszacowania te wskazują, że udział czynników genetycznych w patogenezie tej wady jest duży, a zatem zasadne jest poszukiwanie markerów genetycznych wskazujących na predyspozycję danego osobnika do rozwinięcia CHD. Identyfikacja takich markerów daje szansę na bardzo wczesną diagnozę zwiększonego ryzyka wystąpienia tej wady. Ponadto stwarza możliwości stopniowego ograniczania występowania CHD w danej rasie, poprzez planowanie kojarzeń z udziałem zwierząt, w których genotypie nie ma niepożądanych markerów.Poszukiwanie markerów genetycznych dla chorób czy wad złożonych może być prowadzone m.in. w oparciu o wiedzę na temat podłoża analogicznej jednostki chorobowej u innego gatunku (np. człowieka), poszukiwania markerów genetycznych wykazujących związek (asocjację) z występowaniem nieprawidłowego fenotypu czy porównawczą analizę ekspresji genów w tkankach prawidłowych i nieprawidłowych. Współcześnie za metody szczególnie przydatne w takich badaniach uznaje się skanowanie całego genomu przy pomocy mikromacierzy SNP (GWAS – genomwide association study) oraz sekwencjonowanie DNA nowej generacji (NGS – next generation sequencing),a ich celem jest identyfikacja regionów chromosomowych (QTL – quantitative trait locus), w których mogą być obecne warianty genowe związane z badaną cech czy chorobą dziedziczną. Metodologia takich badań została omówiona na przykładzie otyłości – powszechnej choroby psów o złożonym uwarunkowaniu (24).Podkreślić również należy, że podłoże dziedziczne dysplazji stawu biodrowego badane jest równie u ludzi (4), zatem wiedza o markerach tej wady u ludzi może być wykorzystywana do typowania markerów kandydujących, które warto objąć badaniami u psów. Przykładem poszukiwania markera genetycznego jest wytypowanie genu FBN2, kodującego fibrylinę 2,który jest położony w chromosomie 11 psa (CFA11,Canis familiaris chromosom nr 11), jako kandydującego dla predyspozycji do CHD (9). Wskazany region chromosomowy był wcześniej opisany jako potencjalnie związany z obrzękiem stawu biodrowego psów (27). W oparciu o wyniki skanowania genomu, wiedzę o pełnionej funkcji przez białko FBN2 oraz mutacje opisane u ludzi borykających się z zaburzeniami rozwoju układu szkieletowego, gen ten został objęty analizą molekularną. Sekwencjonowanie tego genu przeprowadzono w kilku rasach, w tym: labrador retriever, owczarek niemiecki, border collie,golden retriever, nowofundland i rottweiler. Badania zaowocowały wykryciem delecji 10 nukleotydów w intronie 30 tego genu (9). Mechanizm oddziaływania tej delecji na rozwój stawu biodrowego psów pozostaje jednak niewyjaśniony. Stwierdzono jedynie, że psy homozygotyczne pod względem delecji miały znacznie obniżony poziom transkryptu tego genu. Labradory z takim genotypem cechowały się również znacznie gorszymi wynikami radiologicznymi stawów biodrowych, w porównaniu z heterozygotami i osobnikami posiadającymi dwa prawidłowe allele.Podobną sytuację zaobserwowano u innych ras, co sugeruje, że może to być uniwersalny, a nie rasowo specyficzny, marker genetyczny. Wiele mutacji genu FBN2 odpowiedzialnych za dolichostenomelię ludzi (nieprawidłowo długie kończyny) zostało opisanych w intronie 30 lub regionach sąsiadujących (19, 20).Dotychczasowe poszukiwania markerów genetycznych predyspozycji do CHD prowadzone były przede wszystkim w dwóch rasach – owczarek niemiecki i labrador retriever, dlatego wyniki badań prowadzonych w tych rasach omówiono poniżej.Markery genetyczne CHD owczarków niemieckich. Poligeniczny model dziedziczenia CHD oraz segregacja genu z dużym efektem działania (major gene)została zaproponowana dla owczarków niemieckich na podstawie analizy ponad 8,5 tys. zwierząt pochodzących z dwudziestu 3- lub 4-pokoleniowych rodzin,które były diagnozowane w kierunku tej wady (14)Kolejne badania przeprowadzono z wykorzystaniem 261 markerów mikrosatelitarnych, rozmieszczonych dość równomiernie w genomie psa, czyli we wszystkich autosomach i chromosomie X. Efektem tych poszukiwań była identyfikacja dziewięciu regionów QTL w chromosomach psa (CFA –Canis familiaris): CFA1,CFA3, CFA4, CFA8, CFA9, CFA16, CFA19, CFA26 i CFA33, które mogą mieć związek z rozwojem CHD u owczarków niemieckich (18). Wykorzystanie metodologii GWAS wskazało na silny związek 5 polimorfizmów typu SNP (Single Nucleotide Polymorphism)z tą wadą. Polimorfizmy te zlokalizowane były w chromosomach: CFA19, CFA24, CFA26 i dwa w CFA34. W celu zweryfikowania ich związku z CHD ustalonogenotypy psów dużej grupy (843 zwierzęta) i stwierdzono, że najsilniejszy związek miał polimorfizm zlokalizowany w chromosomie CFA24, a następnie w CFA26 i jeden z polimorfizmów w CFA34 (6).Podkreślić należy, że w pobliżu markera SNP w chromosomie CFA24 znajduje się locus genu SRC, któryzaangażowany jest w m.in. w tworzenie kości. Kolejne analizy molekularne polegały na sekwencjonowaniu fragmentu o długości 200 tys. par zasad (200 kpz), który obejmował 17 zidentyfikowanych wcześniej regionów QTL (7). W efekcie ustalano genotypy w wybranych loci w tej samej, co we wcześniejszych badaniach, grupie 843 owczarków niemieckich.Analizy asocjacyjne wykazały najsilniejszy związek pomiędzy CHD a polimorfizmami zlokalizowanymi w chromosomach CFA3, CFA9, CFA26, CFA33 i CFA34. W pobliżu najsilniej zasocjowanego polimorfizmu z chromosomu CFA34 znajduje się gen TRIO, stanowiący obiecujący gen kandydujący ze względu na funkcje kodowanego białka, które odrywa istotną rolę w procesie proliferacji i różnicowania chondrocytów.Do genów kandydujących, zlokalizowanych w pięciu wskazanych chromosomach, w sumie zaliczono aż 13 genów: PGM2, FGDR1 (CFA3), COL11A1(CFA9), MMP11, CABIN1 (CFA26), EPHA3, EPHA6,ABI3BP, SENP7, PCNP (CFA33), wspomniany powyżej TRIO, SLC6A3 i FGF12 (CFA34), z których wiele zaangażowanych jest w kontrolę formowania kości czy włókien kolagenowych (7).
Markery genetyczne CHD labradorów
W 2005 podjęto próbę poszukiwania regionów chromosomowych związanych z występowaniem CHD. Wykorzystano wówczas rzadko stosowane podejście, jakim było krzyżowanie psów rasy labrador retriever obciążonych CHD oraz zdrowych (bezobjawów CHD) zwierząt zrasy greyhound. W trzech uzyskanych pokoleniach (152 psów) ustalono genotyp w 240loci sekwencji mikrosatelitarnych, rozproszonych równomiernie we wszystkich autosomach i chromosomie X. Potencjalne regiony QTL dla CHD wskazano aż w 12 chromosomach: CFA4, CFA9,CFA10, CFA11, CFA16, CFA20, CFA22, CFA25,CFA29, CFA30, CFA35, CFA37 (25). W kolejnych badaniach, również opartych na markerach mikrosatelitarnych,analizowano genotyp w 276 takich loci a ich efektem było wskazanie QTL w 7 chromosomach:CFA1, CFA2, CFA10, CFA20,CFA22 i CFA32 (22). Porównanie przedstawionych powyżej wyników, opartych o skanowanie genomu przy pomocy markerów mikrosatelitarrnych, wskazuje na ograniczoną zbieżność w zakresie identyfikacji QTL, bowiem tylko 3 chromosomy (CFA10 i CFA20, CFA22) zostały wskazane w obu badaniach. Dwie wysokoprzepustowe techniki analizy genomu(GWAS i NGS) wykorzystano do poszukiwania regionów QTL. Pierwsze z tych badań, opartych o analizę 22 tys. markerów SNP, wskazało na SNP w chromosomach: CFA1, CFA5, CFA8, CFA20, CFA25,CFA32, a najsilniejszy efekt przypisano regionow w CFA8 (17). Co ciekawe, region ten pokrywa się z regionem wskazanym przy poszukiwaniu markerów CHD u owczarków niemieckich (18). Kolejny region, zlokalizowany w chromosomie CFA1, wykazał słabszy związek z CHD, jednakże jego pozycja pokrywa się z wcześniejszymi wynikami, które także dotyczyły labradorów (22). W chromosomie CFA20 również potwierdzono obecność wcześniej wskazanego regionu zasocjowanego z CHD (25). Spośród wielu genów, których loci znajdują się we wskazanych regionach,wytypowano kilka genów kandydujących (LAMA2,LRR1, COL6A3, GDF15, COMP i CILP2). W chromosomie 8, który wykazał obecność najsilniej związanego polimorfizmu SNP, znajduje się locus LRR1.W 2015 wykonano GWAS przy użyciu 170 000 markerów typu SNP oraz genotypowanie polimorfizmów typu SNP zlokalizowanych w genach kandydujących i wyznaczonych wcześniej regionach QTL(3). Opracowany model predykcyjny, mający służyć do przewidywania CHD u psów rasy labrador retriever uwzględnia polimorfizmy typu SNP występujące w 7 genach kandydujących lub ich pobliżu (tab. 2). Gen CHST3 koduje enzym zaangażowany w reakcję sulfatacji chondroityny, która jest ważnym składnikiem tkanki chrzęstnej. U ludzi opisano mutacje CHST3 wywołujące wrodzone zaburzenia rozwoju układu szkieletowego (12). Gen RAB7A koduje białko będące członkiem rodziny białek pełniących różnorodne funkcje w organizmach żywych, w tym również zaangażowanych w procesy związane z aktywnością komórek kościogubnych (osteoklasty). Kolejne dwa geny, CHSY1 i ADAMTS17, kodują, odpowiednio: syntazę siarczanu chondroityny i białko zawierające domenę dezintegryny, metaloproteinazy i dodatkowo trombospondyn 17. Z kolei PKCE jest enzymem z grupy kinaz, który zaangażowany jest w różnorodne szlaki sygnalizacyjne komórek. Ostatni z uwzględnionych w modelu gen FGF4 koduje czynnik wzrostu fibroblastów 4, biorący udział w wielu biologicznych procesach, takich jak: rozwój zarodkowy, wzrost komórek, morfogeneza, naprawa tkanek oraz wzrost komórek nowotworowych i ich inwazję. Polimorfizmy uwzględnione w modelu zostały przedstawione w tab. 2.
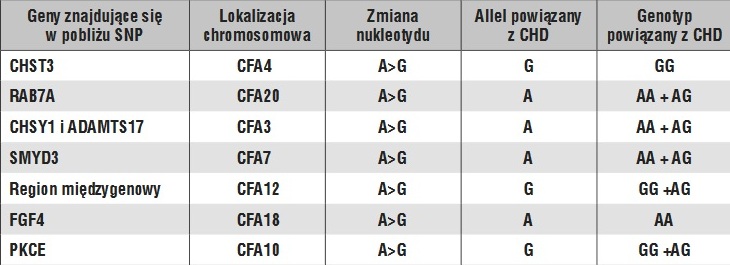
Głównym celem kolejnych badań było znalezienie konkretnych markerów, które można byłoby wykorzystać w diagnostyce genetycznej psów. W 2016 r. przeprowadzono kolejne skanowanie genomu, ustalając genotypy dla 180 000 markerów typu SNP w powiązaniu z występowaniem złożonych chorób psów (11). W tym celu wykorzystano w badaniach materiał pochodzący od 4224 psów należących do ponad 150 ras, jak również 170 psów nierasowych. Jedną zanalizowanych wad była dysplazja stawu biodrowego. Efektem tych badań było wytypowanie nowego markera – polimorfizmu genu CTBP2, położonego w chromosomie CFA28. Kodowane przez ten gen białko jest zaangażowane w szlak sygnalizacyjny Wnt, który ogrywa istotną rolę w kontrolowaniu przebudowy kości. W badaniach asocjacyjnych dotyczących CHD wykorzystano 921 psów należących do 69 ras, a powyżej wspomniany marker miał silny związek z CHD jedynie labradorów i golden retrieverów, a brak takiego związku zauważono u owczarków niemieckich. Znaczenie tego polimorfizmu zostało potwierdzone w najnowszych badaniach, w których ponadto wskazano dodatkowo dwa inne markery zlokalizowane w pobliżu genów TRIM2 (CFA15) i DPP4 (CFA36) (13).Współczesna medycyna weterynaryjna w coraz większym stopniu wykorzystuje osiągnięcia genetyki i genomiki zwierząt. Poszukiwanie markerów DNA związanych z predyspozycją do chorób i wad dziedzicznych o złożonym uwarunkowaniu przyniosła obiecujące efekty, polegające na wskazaniu co najmniej 10 potencjalnych markerów CHD, głównie u psów rasy labrador retriever. Wśród nich na szczególną uwagę zasługują te, których znaczenie zweryfikowano w niezależnych badaniach. W przypadku labradorów mogą to być markery typu SNP występujące w obrębie genów CTBP2, LAMA2 i LRR1, a także marker insercyjno-delecyjny (indel) w genie FBN2, który wykazuje związek z CHD także innych ras.
PAULINA KRZEMIŃSKA, MACIEJ GOGULSKI*,
ROMAN ALEKSIEWICZ**, MAREK ŚWITOŃSKI
Katedra Genetyki i Podstaw Hodowli Zwierząt, *Uniwersyteckie Centrum Medycyny Weterynaryjnej,
**Instytut Weterynarii, Wydział Medycyny Weterynaryjnej i Nauk o Zwierzętach,
Uniwersytet Przyrodniczy w Poznaniu, ul. Wojska Polskiego 28, 60-637 Poznań
Piśmiennictwo1.Aleksiewicz R., Adamiak Z., Fabisz R., Niedziela D., Bojarski M.:Effectivenessof modified chiari osteotomy and intertrochnateric osteotomy in the treatmentof canine hip dysplasia. Bull. Vet. Inst. Pulawy 2010, 54, 409-413.2.Aleksiewicz R., Budzińska Z., Nowicki M., Adamiak Z., Lisiecka B: Caninehip dysplasia of selected breeds, results obtained by two Polish clinics basedon radiological examination conducted in 1997-2006. Pol. J. Vet. Sci. 2008,11, 139-142.3.Bartolome N., Segarra S., Artieda M., Francino O. iwsp.: A genetic predictivemodel for canine hip dysplasia: integration of genome wide association study(GWAS) and candidate gene approaches. PloS ONE 2015, 10, e0122558.4.Basit S., Hannan M. A., Khoshhal K. I.: Developmental dysplasia of the hip:usefulness of next generation genomic tools for characterizing the underlyinggenes – a mini review. Clin. Genet.2016, 90, 16-20.5.Coopman F., Verhoeven G., Saunders J., Duchateau L., Van Bree H.: Prevalence of hip dysplasia, elbow dysplasia and humeral head osteochondrosis in dogbreeds in Belgium. Vet. Rec. 2008, 163, 654-658.6.Fels L., DistlO.: Identification and validation of quantitative trait loci (QTL)for canine hip dysplasia (CHD) in German shepherd dogs. PloS ONE 2014,9, e96618.7.Fels L., Marschall Y., Philipp U., Distl O.: Multiple loci associated with canine hip dysplasia (CHD) in German shepherd dogs. Mamm. Genome 2014, 25,262-269.8.Fischer A., Flöck A., Tellhelm B., Failing K., Kramer M., Thiel C.: Static and dynamic ultrasonography for the early diagnosis of canine hip dysplasia.Small. Anim. Pract. 2010, 51, 582-588.9.Friedenberg S. G., Zhu L, Zhang Z., Foels W., Schweitzer P. A., Wang W.,Fisher P. J., Dykes N. L., Corey E., Vernier-Singer M., Jung S. W., Sheng X.,Hunter L. S., McDonough S. P., Lust G., Bliss S. P., Krotscheck U., Gunn T.M.,Todhunter R. J.: Evaluation of a fibrillin 2 gene haplotype associated with hip dysplasia and incipient osteoarthritis in dogs. Am. J. Vet. Res. 2011, 72,530-540.10.Gülanber E. G., Gülanber N. G., Albayrak N. R., Özer K., Aktaş M., Aksoy ÖUse of distraction radiography in canine hip dysplasia: comparison of early andlate results with two different distractors. Med. Weter. 2006, 62, 1245-1248.11.Hayward J. J., Castelhano M. G., Oliveira K. C., Corey E., Balkman C.,Baxter T. L., Casal M. K., Center S. A., Fang M., Garrison S. J., Kalla S. E.,KornilievP., Kotlikoff M. I., Moise N. S., Shannon L. M., Simpson K. W., Sutte B., Todhunter R. J., Boyko A. .: Complex disease and phenotype mappingin the domestic dog. Nat. Commun.2016, 7, 10460.12.Hermanns P., Unger S., Rossi A., Perez-Aytes, Cortina H, Bonafe L, BocconeL.,Setzu V., Dutoit M., Sangiorgi L., Pecora F. G., Reicherter K., Nishimura G.,Spranger J., Zabel B., Superti-Furga A.: Congenital joint dislocations caused by carbohydrate sulfotransferase 3 deficiency in recessive Larsen syndromeand humero-spinal dysostosis. Am. J. Hum. Genet. 2008,82, 1368-1374.13.Huang M., Hayward J. J., Corey E., Garrison S. J., Wagner G. R., KrotscheckU.,Hayashi K., Schweitzer P. A., Lust G., Boyko A. R., Todhunter R. J.: A noveliterative mixed model to remap three complex orthopedic traits in dogs. PloSONE2017, 12, e0176932.14.Janutta V., Hamann H., Distl O.: Complex segregation analysis of canine hip ysplasia in German shepherd dogs. J. Hered. 2006, 97, 13-20.15.Jońska J., Narojek T.: Anatomia ultrasonograficzna stawu biodrowego psa.Med. Weter. 2006, 62, 323-326.16.King M. D.: Etiopathogenesis of Canine Hip Dysplasia, Prevalence, andGenetics. Vet. Clin. North Am. Small Anim. Pract. 2017, 47, 753-767.17.Lavrijsen I. C. M., Leegwater P. A. J., Martin A. J., Harris S. J., TryfonidouA., Heuven H. C. M., Hazewinkel H. A.: Genome wide analysis indicatesgenes for basement membrane and cartilage matrix proteins as candidates forhip dysplasia in labrador retrievers. PloS ONE 2014,9, e87735.18.Marshall Y., Distl O.:Mapping quantitative trait loci for canine hip dysplasiain German Shepherd dogs. Mamm. Genome2007, 18, 861-870.19.Maslen C., Babcock D., Raghunath M., Steinmann B.: A rare branch-pointmutation is associated with missplicing of fibrillin-2 in alarge family withcongenital contractural arachnodactyly. Am. J. Hum. Genet.1997, 60, 1389--1398.20.Nishimura A., Sakai H., Ikegawa S., Kitoh H., Haga N., Ishikiriyama S.,Nagai T., Takada F., Ohata T., Tanaka F., Kamasaki H., Saitsu H., Mizuguci T.,Matsumoto N.: FBN2, FBN1, TGFBR1, and TGFBR2 analyses in congenitalcontractural arachnodactyly. AmMed. Genet.2007, 143A, 694-698.21.Oberbauer A. M., Keller G. G., Famula T. R.: Long-term genetic selectionreduced prevalence of hip and elbow dysplasia in 60 dog breeds. PloS ONE2017, 12, e0172918.22.Phavaphutanon J., Mateescu R. G., Tsai K. L., Schweitzer P. A., Corey E.E.,Vernier-Singer M. A., Williams A. J., Dykes N. L., Murphy K. E., Lust G.,Todhunter R. J.: Evaluation of quantitative trait loi for hip dysplasia inLabradorRetrievers. Am. J. Vet. Res. 2009, 70, 1094-1101.23.Switonski M.: Dog as a model in studies on human hereditary diseases andtheir gene therapy. Reprod. Biol. 2014, 14, 44-50.24.Switonski M., Mankowska M.: Dog obesity – the need for identifying predisposing genetic markers. Res. Vet. Sci. 2013, 95, 831-836.25.Todhunter R. J., Mateescu R., Lust G., Burton-Wurst N. I., Dykes N. L., BlissP., Williams A. J., Vernier-Singer M., Corey E. wsp.: Quantitative trait loci for hip dysplasia in acrossbreed canine pedigree. Mamm. Genome2005, 16,720-730.26.Vezzoni A., Dravelli G., Vezzoni L., De Lorenzi M., Corbari A., Cirla A.,Nassuato C., Tranquillo V.: Comparison of conservative management and uvenile pubic symphysiodesis in the early treatment of canine hip dysplasia.Vet. Comp. Orthop. Traumatol. 2008, 21, 267-279.27.Zhu L., Zhang Z., Feng F., Schweitzer P., Phavaphutanon J., Vernier-SingerM.,Corey E., Friedenberg S., Mateescu R., Williams A., Lust G., Acland G.,Todhunter R.: Single nucleotide polymorphims refine QTL intervals for hipjoint laxity in dogs. Anim. Genet.2008, 39, 141-146